新聞網(wǎng)訊 近日,醫(yī)學(xué)部轉(zhuǎn)化醫(yī)學(xué)研究院付欽瑞教授團隊和北京化工大學(xué)宋繼彬教授團隊在Aggregate(https://onlinelibrary.wiley.com/doi/10.1002/agt2.652����;IF=13.9,中科院一區(qū),)合作發(fā)表了題為“Biomarker-induced gold aggregates enable activatable near-infrared-II photoacoustic image-guided radiosensitization”的研究論文���,轉(zhuǎn)化醫(yī)學(xué)研究院付欽瑞教授為第一作者���,青島大學(xué)轉(zhuǎn)化醫(yī)學(xué)研究院為第一單位。該研究得到山東省泰山學(xué)者青年項目����、山東省自然科學(xué)基金、青島市自然科學(xué)基金����、人才助力計劃項目和青島大學(xué)“醫(yī)學(xué)+”學(xué)科集群聯(lián)合探索項目支持。
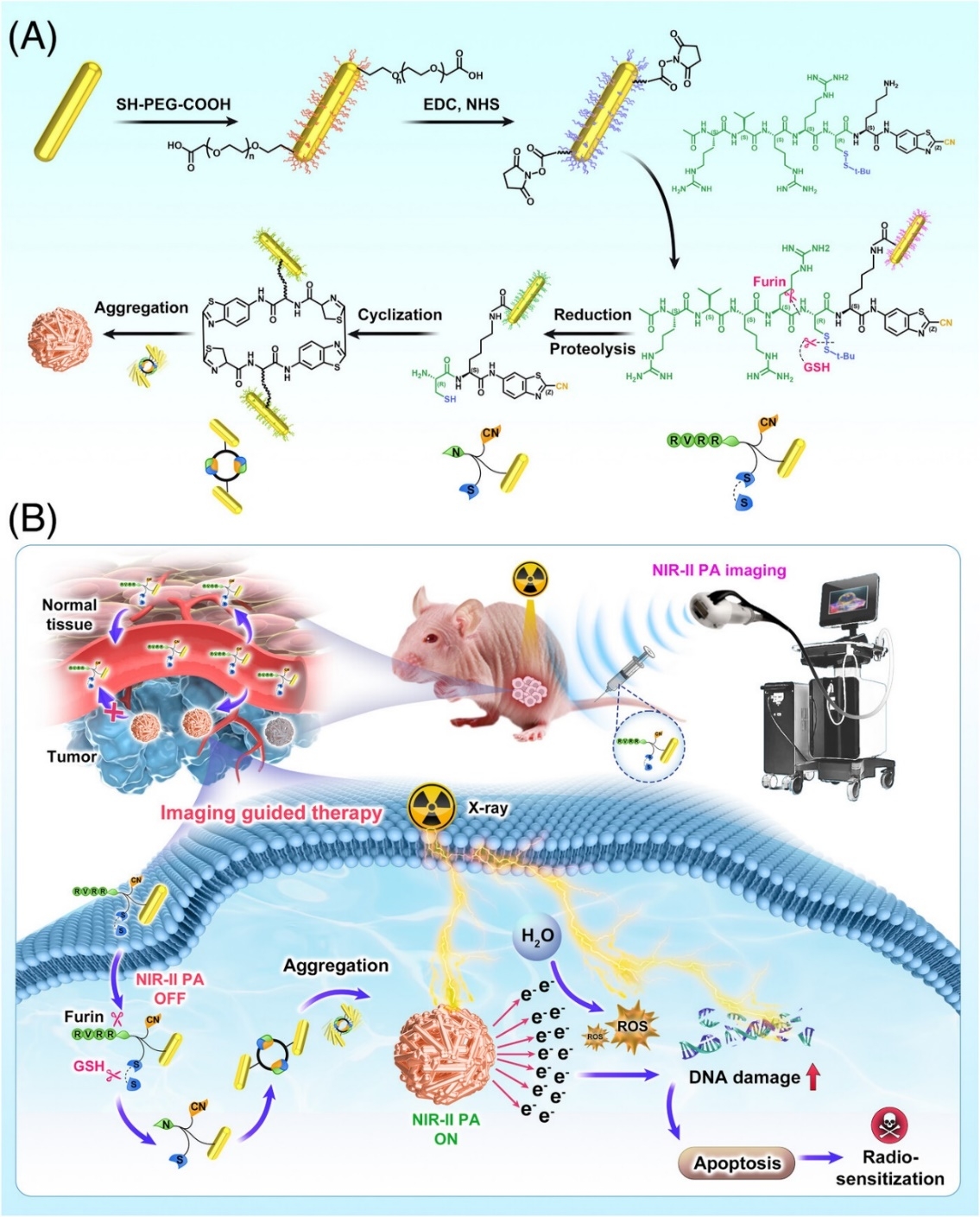
目前的放射治療缺乏準(zhǔn)確區(qū)分腫瘤組織和健康組織的能力���,導(dǎo)致患者遭受嚴(yán)重的放射損傷�。因此�,迫切需要精準(zhǔn)的放療技術(shù),以優(yōu)化腫瘤控制��,同時最大限度地減少對周圍健康組織的不良影響。在這項研究中�����,作者開發(fā)了一種由弗林酶響應(yīng)的RVRR肽偶聯(lián)的金納米棒組成的納米藥物(AuNR@Peptide)��,它將可激活的成像探針和放射增敏劑整合到一個系統(tǒng)中���,用于精確的腫瘤定位���,實現(xiàn)圖像指導(dǎo)的精準(zhǔn)放療。靜脈給藥后���,生物標(biāo)志物(弗林酶)對AuNR@Peptide上的RVRR底物進行蛋白水解��,觸發(fā)金納米棒組裝成更大的聚集體,由于金納米粒子間的等離子耦合效應(yīng)從而激活近紅外二區(qū)光聲信號�,此外,粒徑更大的聚集體通過阻止金納米棒的遷移和回流來增強其瘤內(nèi)滯留����,從而提高其輻射敏感性。注射后在腫瘤部位觀察到近紅外二區(qū)光聲信號的峰值時間點可作為啟動X-射線輻射時間點的參考�,并通過與放射增敏機制相關(guān)的研究闡明增敏機制,體內(nèi)實驗表明其放療效果有實質(zhì)性改善。本研究將影像與治療相結(jié)合��,為腫瘤提供了一種有前景的影像指導(dǎo)治療方式�����。
付欽瑞課題組致力于病理微環(huán)境響應(yīng)型納米藥物的構(gòu)建及其在影像指導(dǎo)疾病治療中的應(yīng)用研究���,在學(xué)生培養(yǎng)���、學(xué)術(shù)論文等方面均取得了一定的成績。高水平論文產(chǎn)出方面���,2022年至今已在ACS Nano����、Advanced Functional Materials���、Angewandte Chemie International Edition���、Chem. Eng. J.、J. Control. Release�、Small�����、Theranostics�����、Advanced Healthcare Materials等國際知名刊物發(fā)表論文20余篇�。






![]() 魯公網(wǎng)安備 37021202000856號
魯公網(wǎng)安備 37021202000856號 ![]()